Внутрішня енергія ідеального газу: складові та визначення

Зміст:

Внутрішня енергія – це сума всіх енергій молекул, яку вони мають через своє власне рухання. Внутрішня енергія системи залежить від кількості молекул, від їх руху і від взаємодії з іншими молекулами.
Якщо ми порушимо умови рівноваги в системі, тоді зміниться і її внутрішня енергія. Відповідно до закону збереження енергії, внутрішня енергія системи може змінюватися шляхами обміну теплом і виконанням роботи.
Внутрішня енергія ідеального газу складається з двох компонентів: кінетичної та потенційної енергії. Кінетична енергія пов’язана з рухом молекул газу, а потенційна енергія – з взаємодією молекул.
Кінетична енергія визначається температурою газу та масою молекул. Вища температура веде до більшої кінетичної енергії молекул, що в свою чергу збільшує внутрішню енергію системи. Отже, кінетична енергія пропорційна температурі і масі молекул. Потенційна енергія пов’язана з взаємодією молекул між собою та з іншими тілами. Вона залежить від способу взаємодії молекул та від взаємного розташування.
Внутрішня енергія ідеального газу

Внутрішня енергія ідеального газу є функцією тільки температури, оскільки не залежить від об’єму, тиску або складу газу. Це означає, що зміна температури прямо пропорційна зміні внутрішньої енергії газу.
Складові внутрішньої енергії ідеального газу включають:
- Кінетичну енергію – є енергія руху молекул газу. Кінетична енергія пропорційна температурі газу і залежить від середньої кінетичної енергії частинок.
- Потенціальна енергія – є енергія взаємодії молекул газу. Вона залежить від відстані та взаємної орієнтації частинок газу. Для ідеального газу, де взаємодія між частинками є знехтувано малою, потенціальна енергія майже не враховується.
- Внутрішня енергія взаємодії молекул – є енергія, пов’язана з взаємодією між частинками газу. Це означає, що молекули газу взаємодіють між собою через сили притягання або відштовхування. Внутрішня енергія взаємодії може враховуватися при дослідженні реальних газів, де взаємодія між частинками має значне значення.
Внутрішня енергія ідеального газу може бути виміряна експериментально за допомогою калориметрії, яка дозволяє визначити зміну внутрішньої енергії під час процесу. Знання внутрішньої енергії ідеального газу є важливим для розуміння його фізичних властивостей та поведінки під впливом різних факторів.
Складові внутрішньої енергії
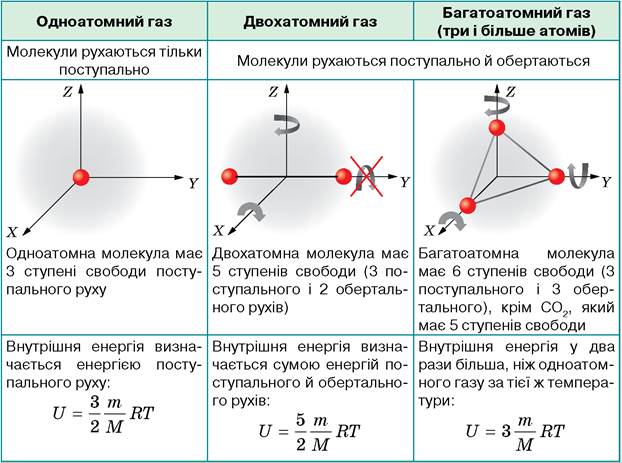
Іншою складовою внутрішньої енергії є потенціальна енергія, пов’язана з взаємодією між молекулами газу. Ця енергія може залежати від розміру, форми та властивостей молекул, а також від сили взаємодії між ними.
Також, внутрішня енергія газу може містити інші форми енергії, такі як енергія електромагнітного випромінювання, енергія взаємодії з електричним або магнітним полем тощо. Загальна внутрішня енергія газу визначається як сума всіх складових енергій.
Розуміння складових внутрішньої енергії ідеального газу дозволяє зрозуміти його термодинамічні властивості та поведінку в різних умовах.
Визначення внутрішньої енергії ідеального газу

Внутрішня енергія ідеального газу залежить лише від його температури і маси. Вона не залежить від об’єму газу і не змінюється при його розширенні або стисненні, а також при зміні тиску. Це відбувається за умови, що газ діє окремо від зовнішніх факторів, таких як нагрівання або охолодження.
Внутрішня енергія ідеального газу обчислюється за формулою:
- Загальна внутрішня енергія = кінетична енергія + потенційна енергія
- Кінетична енергія = (3/2) * R * T, де R – універсальна газова стала, T – температура газу в абсолютних одиницях
- Потенційна енергія = 0, оскільки молекули ідеального газу вважаються точками без розмірів
Таким чином, внутрішню енергію ідеального газу можна визначити, знаючи його температуру за допомогою простої математичної формули. Це дозволяє вивчати властивості ідеального газу та проводити розрахунки, які є важливими в фізиці і хімії.





